앞선 글에서 탄수화물과 지방의 암세포 에너지 대사 경로를 알아봤습니다. 이번에는 단백질의 암세포 에너지 대사 경로에 대해 알아보겠습니다.
탄수화물과 지방이 주로 에너지원으로 쓰이는데 비해 단백질은 신체 구성물질로 더 많이 사용됩니다. 그렇다고 에너지 생산과 전혀 관계없는 것은 아닙니다. 여러 경로를 통해 에너지원으로 사용되니까요.
단백질을 쪼개면 20여가지의 아미노산이 됩니다. 아미노산은 펩티드로 구성돼 있습니다. 아미노산 중 1~3%만 에너지로 사용됩니다. 아미노산은 다양한 결합을 통해 수많은 구조를 만들어 낼 수 있기 때문에 신체의 구성물질부터 체내 효소, 면역 항체, DNA, 연골, 피부, 호르몬 등에 쓰이는 만능물질입니다. 아미노산 9종류는 우리 몸에서 합성할 수가 없으므로 음식을 통해 섭취해야 합니다. 이들을 필수 아미노산이라고 부릅니다.
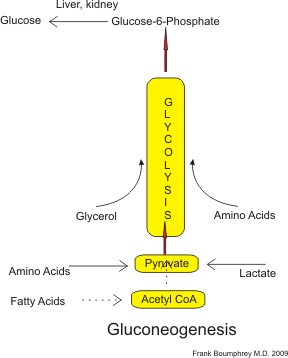
정상세포의 경우, 아미노산은 포도당 신생합성(Gluconeogenesis)를 통해 포도당으로 변환되어 에너지원으로 사용됩니다.<아래 그림 참조> 주로 간이나 신장의 세포에서 이러한 활동이 일어납니다. 그런데 일부 암세포에서는 비필수 아미노산인 글루타민의 흡수와 사용이 비정상적으로 과다하게 진행됩니다.
'글루타민 대사'를 아는 암세포
글루타민은 필수 아미노산이 아닙니다. 하지만 인체에 가장 풍부한 아미노산이며 근육에서 생성돼 각 기관으로 보내집니다. 글루타민은 인체에서 단백질 조직에 사용되고, 기타 아미노산이나 포도당으로 전환되기도 합니다.
1955년 암세포를 연구하던 이글 박사(Eagle)는 많은 암세포에서 글루타민의 흡수가 지나치게 일어나는 반면 다른 아미노산의 흡수는 억제되어 있는 것을 발견했습니다.
이처럼 글루타민을 주요 에너지원으로 사용하는 암세포는 글루타민을 제거하자 성장을 멈추거나 생존 자체가 어려워집니다. 아래 그림을 보면 글루타민이 암세포에서 어떻게 이용되는지 알 수 있습니다.
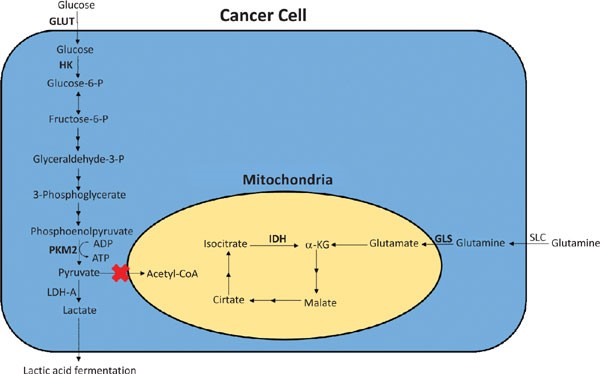
글루타민은 미토콘드리아의 TCA(크랩스 회로)로 들어와 알파-키토글루타르산염(Alpha-ketoglutarate)으로 바뀝니다. 이후 구연산(Citrate), 아세틸CoA로 바뀌어 전자전달계에서 에너지(ATP) 생산에 사용됩니다. 글루타민은 인체에서 포도당에 의해 생산되기도 하는데요. 글루타민을 주로 쓰는 암종의 경우 인체에서 생성된 글루타민 만으로는 필요량을 충족할 수 없다고 합니다.
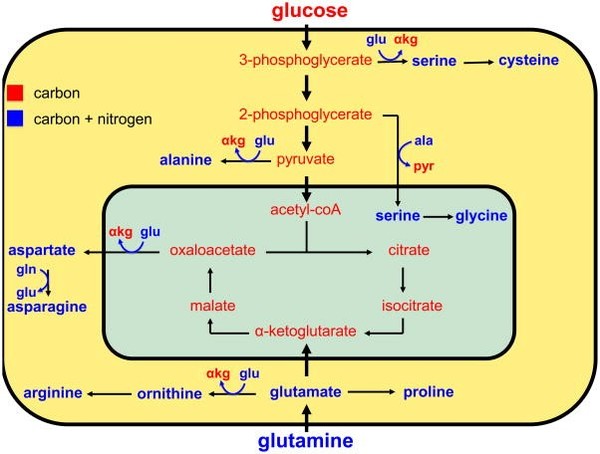
글루타민을 주 에너지원으로 삼는 암세포의 특징은 아래와 같습니다.
1) TCA 사이클을 이용한다.
2) DNA나 RNA를 구성하는 핵산의 원료인 뉴클레오타이드 생성을 위한 질소의 공급원으로 글루타민을 사용한다.
3) 단백질 합성을 위한 공급원으로 글루타민을 사용한다.
4) 암세포 성장을 위한 mTOR 신호를 증가시킨다.
5) 글루타민은 암세포에게 많이 필요한 글루타치온의 전구체이다.
6) 암세포의 산화 스트레스를 억제해서 세포자멸사를 억제한다.
모든 암종이 글루타민 대사에 의존하는 것은 아니지만, 일단 글루타민 대사를 시작해 글루타민에 의존적이 되면 그 암세포는 외부에서 글루타민을 공급받지 못하면 생존이 어려워진다고 합니다.
'글루타민 대사'가 항진(지나치게 활발함)되는 경우
코르베(Corbet) 등의 연구에 따르면 종양의 미세환경이 오랜 기간 산성화 상태에 놓이면 암세포는 글루타민을 사용한 성장을 급격히 진행할 수 있다고 합니다.
종양 미세환경이 산성이 되는 이유는 호기성 해당작용에 의한 젖산 방출 때문일 것입니다. 이런 경우는 종양에 혈액 공급이 부족한 저산조증 상태이거나 산소가 있어도 호기성 해당작용을 하는 바르부르크 효과가 작동하는 상황일 것입니다.
글루타민 대사가 진행되게 만드는 스위치는 종양 미세환경에 축적되는 프로톤(산성화의 원인)을 줄이기 위해 켜집니다. 암세포내 pH 수준을 높이기 위해 (알칼리성으로 만들기 위해서) SIRT1 유전자를 발현시켜 NAD+ 의존적 탈아세화효소를 증가시켜서 지속적으로 글루타민 대사 항진을 유도합니다.
신장암, 간암, 유방 기저세포암종(breast basal cell carcinoma)에는 글루타민을 글루타민산염으로 전환하는 글루타민분해효소(Glutaminase)가 풍부하다고 합니다. 글루타민을 에너지원으로 이용하는데 더 유리할 수 있다는 뜻입니다.
동물성 단백질에서 발견되는 20개의 아미노산 중 하나인 세린 아미노산에 의존하는 암종도 있습니다. 세린은 불필수 아미노산으로, 체내에서 다른 대사 산물로부터 합성될 수 있습니다. 매덕스(Maddocks) 등의 쥐 실험을 통한 연구에서 종양이 있는 쥐에게 세린 성분이 제거된 음식을 공급하자 종양 성장이 억제되었습니다. 특히 p53 단백질이 존재하지 않는 쥐에서 이런 효과가 두드러졌습니다.
그 이유에 대해 야생형 p53을 가진 쥐는 충분한 세린을 생산하지만 p53 변이가 있으면 세린을 덜 생산하기 때문이라고 추측하고 있습니다. p53 유전자의 역할로 세포가 적은 양의 세린에도 적응할 수 있도록 돕는 것이라고 많은 학자들이 생각하고 있습니다.
세린은 암세포에 비정상적으로 발현되어 있는 PKM2의 알로스테릭(Allosteric) 활성자입니다. 즉대부분의 환자들이 유전자 검사를 해보면 p53 변형을 가지고 있습니다. 따라서 세린을 제한하면 PKM2가 억제되면서 호기성 해당작용과 오탄당인산경로가 제한되고, 산화적 인산화로 에너지 생산이 유도되면서 종양의 성장이 억제될 가능성이 있습니다. 하지만 4기 암은 대사적으로 유연하니 산화적 인산화에 대한 방비도 필수라고 생각합니다.
글루타민 공급을 억제로 암 성장 방해
글루타민을 에너지원으로 쓰는 암종에서는 글루타민 대사를 억제할 필요가 있지만, 실제적으로 글루타민을 억제하는 유사체들은 독성이 너무 강해 사용하기 어렵습니다. 글루타민 대사가 완전히 봉쇄되면 암세포는 글루타민 대신 아스파라긴 아미노산을 씁니다. 따라서 글루타민을 억제할 때 아스파라긴이 풍부한 음식도 함께 제한할 필요가 있습니다.
글루타민의 이용율을 낮추는 약물인 페닐부티레이트(phenylbutyrate)을 쓸 수도 있습니다. 그밖에 글루타민 공급을 억제하는데 효과적인 보충제로 글루타민 탈수소효소(GDH) 억제제, 메트포르민, '커큐민 + 레스베라트롤 + 우르솔산 조합'이 있습니다. 글루타민 분해 과정 억제를 치료표적으로 하는 약물에는 글루타민 모방 물질(Glutamine-mimetic compounds)과 글루타민 분해효소(GLS) 억제제, 글루타민 수송(ASCT2) 억제제가 연구 중에 있습니다.

